


Florence plus
Toxická epidermální nekrolýza – Lyellův syndrom
RECENZOVANÝ ČLÁNEK - ZKUŠENOSTI Z PRAXE
Souhrn: Toxická epidermální nekrolýza byla poprvé popsána skotským dermatologem Alanem Lyellem v roce 1956, proto je též označována jako Lyellův syndrom. Je to vzácné onemocnění, které se projevuje rozsáhlou kožní nekrolýzou a systémovou toxicitou. Obvykle jde o závažnou nežádoucí reakci na léky (nejčastěji antibiotika, antikonvulziva, kortikosteroidy a nesteroidní antirevmatika). Toxická epidermální nekrolýza bývá spojena s vysokou mortalitou (30–60 % pacientů). Pouze včasná diagnostika, neodkladné zahájení terapie, kvalitní nutrice a péče o ránu s důkladnou mikrobiologickou monitorací může zlepšovat prognózu pacientů. Připojena je kazuistika těžce postižené mladé ženy vietnamské národnosti, léčené cyklosporinem A.
Klíčová slova: Toxická epidermální nekrolýza – Stevens-Johnsonův syndrom – Lyellův syndrom – erytemato-bulózní onemocnění – lokální terapie.
(Toxic epidermal necrolysis – Lyell‘s syndrome)
Summary: Toxic epidermal necrolysis was first described by Scottish dermatologist Alan Lyell in 1956, it is also known ad Lyell‘s syndrome. It is rare disease that manifests extensive dermal necrolysis and systemic toxicity. Usually it‘s serious adverse reaction to medication (mostly antibiotics, anticonvulsants, NSAIDs etc.). Toxic epidermal necrolysis is associated with high mortality (30–60 %). Only early diagnosis, immediate initiation of therapy, good nutrition and wound care with precise microbiological monitoring, can improve the prognosis of patients. Part of the articel is also case report severely disabled young Vietnamese woman, treated with ciclosporin A.
Key words: Toxic epidermal necrolysis – Stevens-Johnson syndrome – Lyell‘s syndrome, erytemato-bullous disease, local therapy.
Úvod
Lidská kůže (integumentum commune) se skládá ze tří vrstev. Svrchní vrstva – pokožka (epidermis) je tvořena dlaždicovým rohovějícím epitelem. Skládá se zejména z buněk – keratinocytů, které v bazální vrstvě mají tvar cylindrický a směrem k povrchu se zplošťují a postupují ve svém vývoji směrem k povrchu kůže. V poslední fázi vývoje se odlučují jako suché částice tvořené téměř výhradně keratinem. Vedle keratinocytů je pokožka tvořena ještě melanocyty – buňkami obsahujícími kožní barvivo melanin, a dále Langerhansovými buňkami, které jsou odpovědné za lokální imunitní reakci organismu. Poslední ze čtyř hlavních druhů buněk nacházejících se v epidermis jsou Merkelovy buňky, které jsou nahromaděny především v oblasti folikulů sinusových chlupů a fungují jako mechanoreceptory. Epidermis tvoří maximálně 1/10 tloušťky kůže.
Druhou vrstvou vytvářející kůži je škára (korium, dermis), která je tvořena kolagenními a elastinovými vlákny uspořádanými v hlubší vrstvě retikulárně, v povrchnější vrstvě do podoby papil. Kromě těchto vláken je tvořena ještě vazivovými buňkami – fibroblasty a fibrocyty, obsahuje kožní adnexa, nervová zakončení, imunokompetentní buňky a amorfní hmotu. Jako každá živá tkáň je i kůže protkána složitě uspořádanou sítí kapilár zajišťujících její výživu. Kapilární sítě nacházející se ve škáře vyživují pokožku pouze difúzí. Nejhlubší vrstvou kůže je podkoží (subcutis, tela subcutanea), obsahuje řídké pojivo, tukové lalůčky, větší cévy a nervy. Má metabolický význam, chrání před mechanickými vlivy a je izolátorem tepla.
Lidská kůže představuje bariéru mezi vnitřním a vnějším prostředím organismu a je největším a nejtěžším orgánem těla.
Toxická epidermální nekrolýza
Toxickou epidermální nekrolýzu poprvé popsal u čtyř pacientů skotský dermatolog Alan Lyell v roce 1956. Později připustil, že u dvou pacientů se v diagnóze tohoto syndromu mýlil a stanovil u nich dodatečně diagnózu stafylokokového syndromu opařené kůže. Jde o potenciálně život ohrožující polékovou toxoalergickou reakci. Je to akutní bulózní dermatologické onemocnění na autoimunitním základě, které po expozici vyvolávajícího agens progreduje postupně až k exfoliaci epidermis a následně ke kožní ztrátě, defektům různého rozsahu. Lyellův syndrom patří mezi nejzávažnější onemocnění ze skupiny tzv. Burn-like syndromů, které imitují popálení. Toxická epidermální nekrolýza je extrémně vzácné onemocnění s incidencí okolo 0,5–2 případy na 1 milión obyvatel a rok. V rámci věkových skupin bývají nejčastěji postiženi pacienti ve věku 40–60 let, přičemž starší lidé mohou mít relativně vyšší riziko rozvoje tohoto onemocnění, protože užívají více léků. Výskyt Lyellova syndromu je častěji pozorován u pacientů po transplantaci kostní dřeně a u HIV pozitivních pacientů. Ze zatím nevysvětlených příčin bývají častěji postiženy ženy (1,5: 1), s mortalitou onemocnění 40–90 %. Při rozsahu kožních lézí do 10 % tělesného povrchu hovoříme o Stevens-Johnově syndromu (SJS), nad 30 % o klasické toxické epidermální nekrolýze (Lyellův syndrom).
Patofyziologie. Mechanismus onemocnění zůstává nejasný. Etiologickým agens alerického-autoimunitního procesu jsou v převážné většině případů léky. Onemocnění může být způsobeno i infekcí Mycoplasma pneumoniae, viry z čeledi Herpesviridae, reakcí štěpu proti hostiteli po transplantaci kostní dřeně. Hlavní příčinou mortality u pacientů s toxickou epidermální nekrolýzou jsou infekční komplikace, kde mezi typická agens patří nejen bakterie jako Pseudomonas aeruginosa, Acinetobacter baumannii, Koagulasa-negat. staphylococcus, Staphylococcus aureus (MSSA,MRSA), ale také kvasinky a plísně.
Klinické příznaky. Kožním lézím předcházejí prodromální příznaky běžné virózy (až tři týdny po podání léku), které během 1–2 týdnů přecházejí do akutní kožní fáze charakterizované stranově symetricky lokalizovanými erytematózními papulami, rychle pokračující diseminací a splýváním exantému s tvorbou bul a různě rozsáhlé exfoliace epidermis. Velmi časté jsou i slizniční léze (oka, dutiny ústní, urogenitálu), slizniční ulcerace s tvorbou krust v místech kožních i slizničních defektů. Typickým příznakem je pozitivní Nikolského fenomén (zdánlivě normální epidermis může být snadno odloučena smýkavým třením od základních vrstev kůže v důsledku nedostatečné adheze epidermálních buněk.
Celkové příznaky u toxické epidermální nekrolýzy: alterace celkového stavu, febrilie, somnolence, ztráta tekutin, rozvrat elektrolytů a vodní rovnováhy, zvýšená sedimentace, lymfopenie, leukocytóza, zvýšené alfa- a beta-globuliny.
Terapie
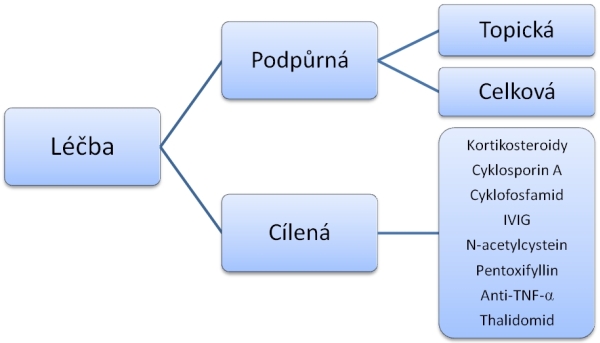
Onemocnění vyžaduje komplexní přístup. Léčbu lze rozdělit na podpůrnou a cílenou. Primárním krokem v terapii toxické epidermální nekrolýzy je vysazení všech léků, které pacient užívá a které jsou potenciálně podezřelé v indukci nemoci. Podpůrnou terapii je možné dále rozdělit na léčbu celkovou a místní (graf. 1).
Základem podpůrné terapie je dostatečná tekutinová resuscitace v závislosti na rozsahu exfoliovaných ploch. I když se v literatuře udává, že u Burn-like syndromů jsou, v porovnání s popáleninou, o něco menší ztráty tekutin, přesto jsou stále značné. Dále je nutno udržovat dostatečnou onkoticko-osmotickou rovnováhu, pravidelné hrazení iontů dle iontogramu, kontrolovat plasmatickou koncentraci dusíkatých látek a do resuscitace jistě zahrnout přirozené koloidy a – jsou-li potřeba – i koloidy syntetické. Pacienti s toxickou epidermální nekrolýzou jsou velmi náchylní k rozvoji infekčních komplikací, které díky terapeutické imunosupresi mohou mít modifikovaný klinický průběh. Proto základem pro úspěšnou terapii těchto stavů je pravidelná mikrobiologická monitorace situace nejen v oblasti exfoliovaných ploch, ale také v dolních dýchacích cestách, krevním řečišti, močovém systému apod. Pokud to není nezbytně nutné, volíme pouze minimální počet invazivních vstupů.
Nutrice. Zahájení včasné enterální výživy bezprostředně po přijetí je dnes doporučováno. V případě rozsáhlých exfoliací v oblasti dutiny ústní je nutno zavést nazogastrickou sondu a v enterální výživě pokračovat. Enterální výživu je vhodné doplnit, zejména u pacientů s rozsáhlejší exfoliací, o výživu parenterální. Na rozdíl od popálených pacientů, kde jsou metabolické nároky velmi vysoké, v případě toxické epidermální nekrolýzy je energetická potřeba pouze mírně nad bazální úrovní.
U těchto pacientů je také důležitá prevence stresového vředu, nízkomolekulární heparinizace, v případě terapie kortikosteroidy terapie rozvoje hyperglykémie či hypertenze. Kontinuální psychologická podpora nejen postižené osoby, ale i rodinných příslušníků je rovněž velmi důležitá.
Lokální terapie. U toxické epidermální nekrolýzy jsou nároky na lokální terapii vysoké. Důležitá je zejména ochrana před mechanickou traumatizací, vysycháním a infekcí exfoliované plochy. Každá takováto plocha má potenciál spontánní reepitelizace, pokud ale dojde k rozšíření mikroorganismů na defektech a k překročení kritické kolonizace, tedy k infekci plochy, defekt se může prohloubit a ztratit tak schopnost přeepitelizování. U popálených pacientů velmi často používaný sulfadiazin stříbra není u pacientů s toxickou epidermální nekrolýzou doporučován, zejména pro obsah sulfonamidové komponenty. S výhodou se u těchto pacientů dají použít algináty (alginogely – Flaminal Hydro) a mikrobiologickou kontrolu zajistit např. roztokem chlorhexidinu. Recentně jsou také do klinické praxe zařazovány syntetické kožní náhrady (Biobrane), které mohou zkracovat dobu reepitelizace.
Cílená terapie. V dnešní době nabízí cílená terapie toxické epidermální nekrolýzy několik možností. Většina z preparátů používaných v této indikaci jsou imunomodulancia. Základním cílem léčby je přímé či nepřímé ovlivnění TNF-α, nebo interakce s vazbou Fas-L na Fas-R, eventuálně indukce down-regulace Fas-R či inaktivace Fas-L před samotnou vazbou na specifický receptor. Nové experimentální postupy se snaží hledat také cestu terapie mimo ovlivnění samotného systému imunitní odpovědí a věnují se zejména problematice zastavení apoptózy buňky.
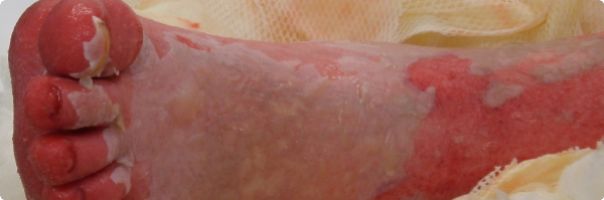
(Obr. 1. /nahoře/: Exfoliace v oblasti dolní končetiny)
Kazuistika
Na JIP Kliniky popálenin a rekonstrukční chirurgie Fakultní nemocnice Brno (KPRCH FN Brno) byla dne 28. 7. 2010 přijata 32letá pacientka vietnamské národnosti s bulózním postižením 95 % celkového tělesného povrchu. K tomuto stavu došlo po léčbě bolestí zad benzodiazepinovým přípravkem obsahujícím tetrazepam. Prvním projevem byl výsev puchýřnatých formací 22. den po prvním podání tetrazepamu, který byl primárně diagnostikován jako erythema exsudativum multiforme. Pacientka byla v té době z nařízení soudu umístěna ve vazební věznici Praha-Ruzyně.
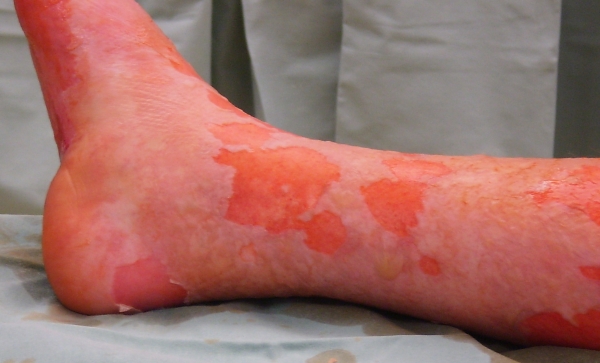
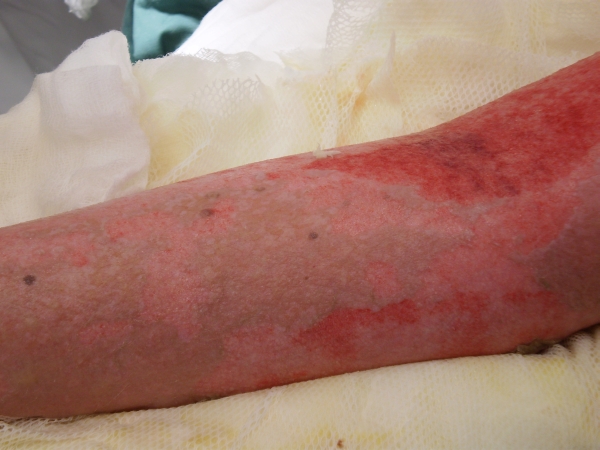
Obr. 2. Exfoliace na dolní končetině Obr. 3. Exfoliace v oblasti horní končetiny
Ihned po vzniku onemocnění byla zahájena terapie kortikosteroidy (Solumedrol) v dávce 3 x 80 mg, ale i přes postupné navyšování dávky až na 1000 mg/den docházelo ke stálému zhoršování onemocnění. Proto byla pacientka přeložena do Vězeňské nemocnice Brno. Zde bylo po vyšetření pacientky dermatologem doporučeno ponechat stávající dávku kortikosteroidů. Lékař dále indikoval zahájení antibiotické terapie kombinací Oxacilin (29. den) a Amoxicilin (31. den). Opakovaně zde byly prováděny převazy exfoliovaných ploch bez použití celkové anestezie, tedy pro pacientku velmi bolestivé. Pro další progres onemocnění byla pacientka 39. den od prvního kontaktu s vyvolávající látkou přeložena na KPRCH JIP.
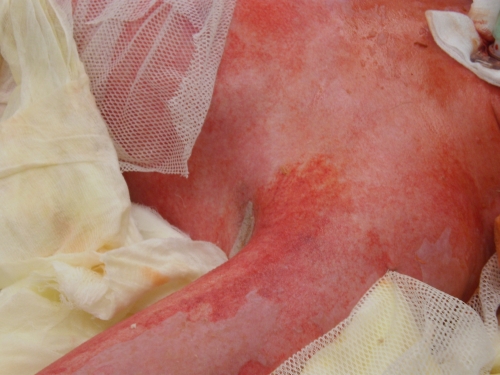
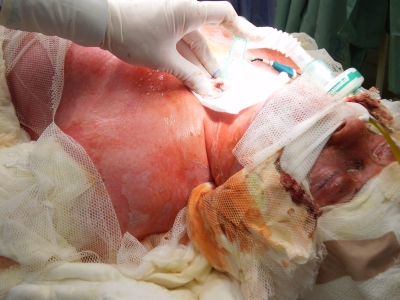
Obr. 4. Exfoliace v oblasti hrudníku a levé paže Obr. 5. Exfoliace v oblasti trupu
Primární evaluace rozsahu a lokalizace exfoliovaných oblastí byla provedena na operačním sále v celkové anestezii, byl zajištěn centrální žilní katetr a po předchozí telefonické domluvě s histopatologem byl odebrán bioptický materiál z pravého předloktí, díky němuž byla potvrzena diagnóza Lyellova syndromu. Rozsah exfoliované oblasti byl 95 % TBSA (Total Body Surface Area – celková plocha tělesného povrchu) s drobným výsevem bul v oblasti bukání sliznice. Na krku a tvářích byl přítomen výsev červených makul bez obsahu, periorbitálně exfoliace. Pokožka vlasové části hlavy zůstala nepostižena. Při vyšetření per rectum a per vaginam sliznice intaktní. Byla provedena mikrobiologická surveillance exfoliovaných defektů, zhodnocen Nikolského fenomén, který byl pozitivní, a plochy byly sterilně kryty mastným tylem s obklady s chlorhexydinem. (P. V. Nikolsky, 1858–1940, v roce 1896 popsal jev, při němž může dojít k odloučení na první pohled zdravé epidermis od základních vrstev kůže.)
V den přijetí byl pacientce proveden standardní odběr krve, včetně CIK (cirkulujících imunokomplexů) a IgE v séru, dále hCG (lidský choriogonadotropin), RPR (netreponemový flokulační test pro průkaz reaginových protilátek proti fosfolipidovým antigenům v séru nebo plazmě – diagnostika syfilis) a TPHA testy (T. pallidum hemagglutination), vše s negativním nálezem. Byla zjištěna pozitivita u IgG na CMV (cytomegalovirus), Anti HAV IgG (protilátky antigenu virové hepatitidy typu A), Anti HBc (kvalitativní stanovení protilátek proti jadernému antigenu viru hepatitidy B) a HBsAg (kvalitativní stanovení povrchového antigenu viru hepatitidy B). Pacientka udávala, že při rozsevu bul byla přeočkována tetanovým antitoxinem, což vzhledem k imunosupresivní terapii kortikosteroidy se jeví jako nedostatečné, proto byl z profylaktických důvodů podán ještě TEGA 250 IU a následně po třech týdnech dávka 250 IU opakována. Pacientka byla dále po přijetí vyšetřena oftalmologem, který popsal pouze exfoliativní postižení víček s normálním očním nálezem. Vyšetření RTG skiagrafie hrudníku neobjevilo žádnou patologii. Vzhledem ke kritickému stavu při přijetí byl nasazen Cyklosporin A o velikosti indukční dávky 5 mg/kg/den. Následující dny se pokračovalo v dávkách o velikosti 4 mg/kg/den. Pravidelně byla sledována plasmatická koncentrace Cyklosporinu A v séru. Léčba trvala 14 dní. Souběžně s imunosupresivní léčbou Cyklosporinem A byly pozvolna snižovány dávky kortikosteroidů s ohledem na prevenci vzniku akutní adrenální surveillance, a to nejen na defektech, ale i v krevním řečišti, v dýchacích a močových cestách. Byly pravidelně odebírány otisky exfoliovaných ploch k semikvantitativnímu hodnocení včetně hodnocení mikrobiologické situace. Standardní odběry byly doplňovány o kultivace na půdách pro kvasinky a plísně. Do diagnostického konceptu byla zakomponována také sérologická diagnostika k určení invazivity mykóz, to znamená manan a galaktomanan. Čtyřicátý den se rozvinul kandidový soor (mykóza), kde byla kultivačně zjištěna Candida albicans a který byl podle citlivosti přeléčen flukonazolem. Následně byla antimykoticko-antibiotická terapie volena podle výsledku mikrobiologického monitoringu s ještě větší intenzitou po 46. dni, kdy byla zjištěna kritická leukopenie klesající až k 1 x 109 /l. V následujících dnech již byly hodnoty leukocytů postupně normalizovány.
Během hospitalizace došlo u pacientky k rozvoji hypertenze s možnou etiologií v léčbě kortikoidy a Cyklosporinem A. Pacientka byla vyšetřena na lůžku lékařem Interní kardiologické kliniky FN Brno pomocí transtorakální echokardiografie (ECHO) s nálezem hraničních hodnot krevního tlaku pro hypertenzi v plicnici, bez další patologie. Byly nasazeny blokátory kalciového (Ca2+) kanálu.
Postupně po kombinované terapii dochází k epitelizaci, zejména trupu a obličeje, následně také končetin. Pouze v oblasti bérců a drobných okrsků na končetinách nebyla pozorována schopnost spontánní reepitelizace, pravděpodobně došlo k prohloubení defektů z lokálních příčin, nejspíše šlo o plochy infikované Klebsiella penumoniae ESBL+. Proto byly tyto defekty s rozsahem 11 % TBSA autotransplantovány dermoepidermálními štěpy. Primární volba místa odběrové plochy byla v místech nepostižených exfoliací.
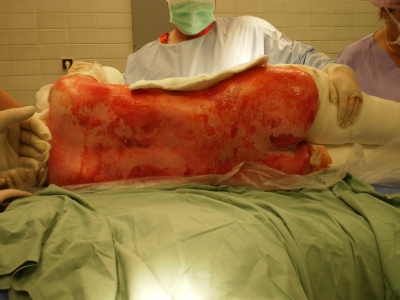
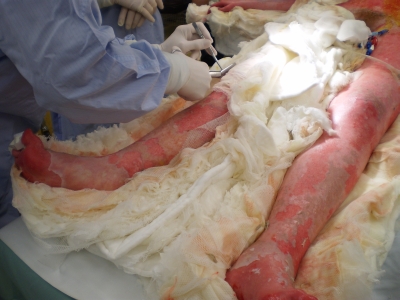
Obr. 6. Rozsáhlá exfoliace v oblasti hýždí a zad Obr. 7. Odstranění primárního krytí – převaz
Převazy byly u pacientky prováděny v celkové anestezii obden. Na plochy byl topicky aplikován Flaminal Hydro.
Po 77 dnech od prvního požití tetrazepamu a po 55 dnech hospitalizace byla pacientka přeložena do Vazební věznice Praha s kompletně zhojenými defekty a snižující se dávkou kortikosteroidů.
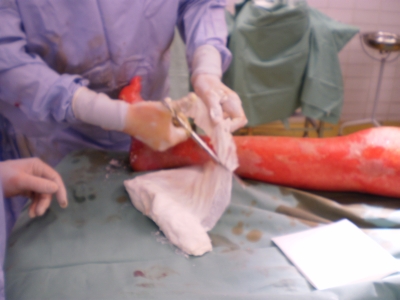
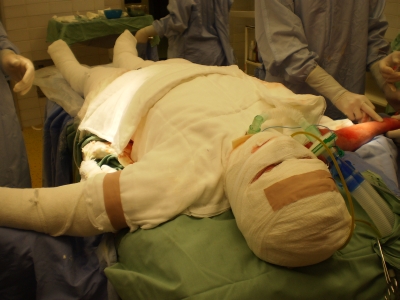
Obr. 8. Převaz – aplikován mastný tyl v kombinaci Obr. 9. Pacientka po ošetření a po převazu
s krémem Flammazine
Ošetřovatelská péče
Zvýšená tělesná teplota z důvodu infekce
Cíl: pacientka bude mít teplotu v normálním rozmezí.
Plán: kontrolovat TT (tělesná teplota) v pravidelných intervalech, zajistit stabilní teplotu prostředí, nabízet dostatečné množství tekutin, při zvýšení TT informovat lékaře a podat antipyretika.
Hodnocení: pacientka je po dobu hospitalizace bez febrilií, jen občas se objeví mírné subfebrilie, po aplikaci antipyretik teplota klesá.
Riziko vzniku infekce z důvodu zavedení centrální žilní kanyly
Cíl: u pacientky nedojde k poškození a vzniku infekce.
Plán: všímat si možných známek infekce a zarudnutí v místě vpichu, pečovat o kanylu a její okolí dle standardu, pravidelně kontrolovat průchodnost vstupů, vést přesné záznamy v dokumentaci.
Hodnocení: okolí kanyly je klidné, bez známek infekce, pravidelně dezinfikováno a sterilně kryto.
Deficit znalostí, vědomostí
Cíl: pacientka bude seznámena s vlastním onemocněním a průběžně informována o principech léčby a ošetřování.
Plán: vysvětlit pacientce všechny diagnostické, terapeutické i ošetřovatelské činnosti, ověřit si, zda rozuměla, motivovat ji ke spolupráci.
Hodnocení: pacientka je informována, spolupracuje, projevuje zájem a je motivována ke spolupráci.
Porucha tkáňové integrity
Cíl: zabránit dalšímu poškození a destrukci tkání, snížit bolest a pocit pálení.
Plán: snažit se posoudit krevní zásobení a inervaci postižených tkání, věnovat pozornost pachům sekretů, měnit polohu pacientky v pravidelných intervalech.
Hodnocení: pacientka je pravidelně polohována, používá antidekubitní podložky, bolest je tlumena farmakologicky dle ordinací ošetřujícího lékaře.
Změna rytmu srdce
Cíl: nebude docházet ke zvýšení krevního tlaku, které převyšuje potřeby organismu (hypertenzi).
Plán: pravidelně sledovat tepovou frekvenci, EKG křivku, měřit krevní tlak v pravidelných intervalech, o změnách informovat ošetřujícího lékaře.
Hodnocení: pacientka je monitorována, hodnoty vitálních funkcí jsou pravidelně zaznamenávány do dokumentace, provedeno kardiologické vyšetření a nasazeny léky dle ordinací konziliárního lékaře.
Riziko vzniku infekce
Cíl: zabránit vzniku či přenosu infekce z důvodu narušení celistvosti kůře a celkovému oslabení organismu.
Plán: sledovat tělesnou teplotu pacientky, dodržovat aseptický přístup, pravidelné mytí a dezinfekce rukou před kontaktem s pacientkou a po něm.
Hodnocení: pacientka je afebrilní, jen místy je objevují subfebrilie, po aplikaci antipyretik klesají, aseptické podmínky zachovány.
Pooperační komplikace
Cíl: zabránit vzniku pooperačních komplikací.
Plán: pravidelně kontrolovat operační ránu a sterilní krytí rány, případně zajistit převaz rány, o změnách ihned informovat ošetřujícího lékaře pacientky.
Hodnocení: operační rána a okolí rány jsou klidné, sterilní krytí zpočátku serózně prosakuje, provádí se výměna sekundárního krytí sterilním krytím, sálové převazy v celkové anestezii se provádějí obden.
Nebezpečí změny vitálních funkcí
Cíl: vitální funkce budou v normě, nedojde ke komplikacím v důsledku jejich změny.
Plán: monitorovat fyziologické funkce, krevní tlak, puls, dech, saturaci. Sledovat prokrvení, cyanózu či případné krvácení z operační rány.
Hodnocení: pooperační stav pacientky je dobrý, vitální funkce v normě, zdravotní stav se postupně zlepšuje.
Závěr
Specifičnost terapie rozsáhlého bulózního onemocnění vyžaduje včasnou diagnostiku, přerušení podávání etiologického agens, aseptický přístup. Pacienti postižení tímto onemocněním mohou profitovat z neprodleného transportu na specializované pracoviště se zkušenostmi s léčbou rozsáhlých kožních defektů a jejich potenciálních komplikací.
I v dnešní době představuje Lyellův syndrom onemocnění s vysokou mortalitou. Vzhledem k raritnímu výskytu v populaci bude velmi obtížné najít konsenzus v účinné terapii.
Literatura:
Vokurka M, Hugo J a kol. Velký lékařský slovník. 5. vyd. Praha: Maxdorf, 2005.
Stella M, Cassano P, Bollero D, Clemente A, Giorio G. Toxic epidermal necrolysis treated with intravenous high-dose immunoglobulins: Our experience. Dermatology 2001; 203: 45–49.
Murphy JT, Purdue GF, Hunt JL. Toxic epidermal necrolysis. J Burn Care Rehabil 1997; 18:417–420.
Saiag P, Caumes E, Chosidow O et al. Drug-induced toxic epidermal necrolysis (Lyell syndrome) in patients infected with the human immunodeficiency virus. J Am Acad Dermatol 1990; 26:567–574.
Pasricha JS et al. Toxic epidermal necrolysis. Int. J Dermatol 1996; 35: 523–7.
Ettore A, Andreassi M, Anselmi C, Neri P, Andreassi L, Di Stefano A: Involvement of oxidative stress in apoptosis induced by a mixture of isothiazolinones in normal human keratinocytes. J Invest Dermatol 2003; 121: 328–336.
Paquet P, Piérard GE. Differential pathomechanisms of epidermal necrolytic blistering diseases. Int J Mol Med 2002; 10: 695–699.
Chave TA, Mortimer NJ, Sladden MJ et al. Toxic epidermal necrolysis: current evidence, practical management and future directions. Br J Dermatol 2005; 153(2):241–253.
Ghislain PD, Roujeau JC. Treatment of severe drug reactions: Stevens-Johnson syndrome, toxic epidermal necrolysis and hypersenzitivity syndrome. Dermatol Online J 2002; 8: 5–15.
Rozsypal S et al. Nový přehled biologie. Scientia, Praha 2003.
Jana Přecechtělová, Klinika popálenin a rekonstrukční chirurgie, Fakultní nemocnice Brno
Recenzoval:
MUDr. Břetislav Lipový, Klinika popálenin a rekonstrukční chirurgie, FN Brno
Fota archiv FN Brno
Další aktuality v této rubrice
- Praktici uzavřou své ordinace – protestují proti nové úhradové vyhlášce
- Lékařské přístroje a elektrochirurgie
- Základní metodický rámec pro realizaci supervize v českém ošetřovatelství
- Je nárůst nemocných trpících mentální anorexií podmíněn společensky?
- Malomocenství – nemoc, kterou trpěl i jeruzalémský král
- Starostlivosť o pacienta s centrálnym venóznym vstupom a jej špecifiká
- FYZIOporadna: Jak posilovat břicho a nezničit si záda? Pozor na sklapovačky
- DEN ZDRAVÍ se STOBem 19. října 2024
- Doporučené postupy k odběrům krve – prevence preanalytické variability
- Inkontinence a možnosti její léčby se zaměřením na rehabilitační léčbu











